
GAMP: linee guida e best practices per la convalida dei sistemi computerizzati
Le linee guida GAMP (Good Automated Manufacturing Practice) rappresentano uno standard globale per garantire la conformità e la sicurezza dei sistemi computerizzati utilizzati nei settori farmaceutico e biotecnologico.
La loro adozione è essenziale per assicurare l’integrità dei dati, la sicurezza dei pazienti e la qualità del prodotto. Pubblicate dalla International Society for Pharmaceutical Engineering (ISPE), le GAMP sono in continua evoluzione per rispondere alle sfide tecnologiche e regolatorie del settore.
Con la pubblicazione della seconda edizione delle GAMP 5 nel 2022, sono stati introdotti aggiornamenti significativi, tra cui l’adozione della metodologia Agile, un maggiore focus sull’integrità dei dati e l’integrazione di tecnologie avanzate come blockchain e intelligenza artificiale.
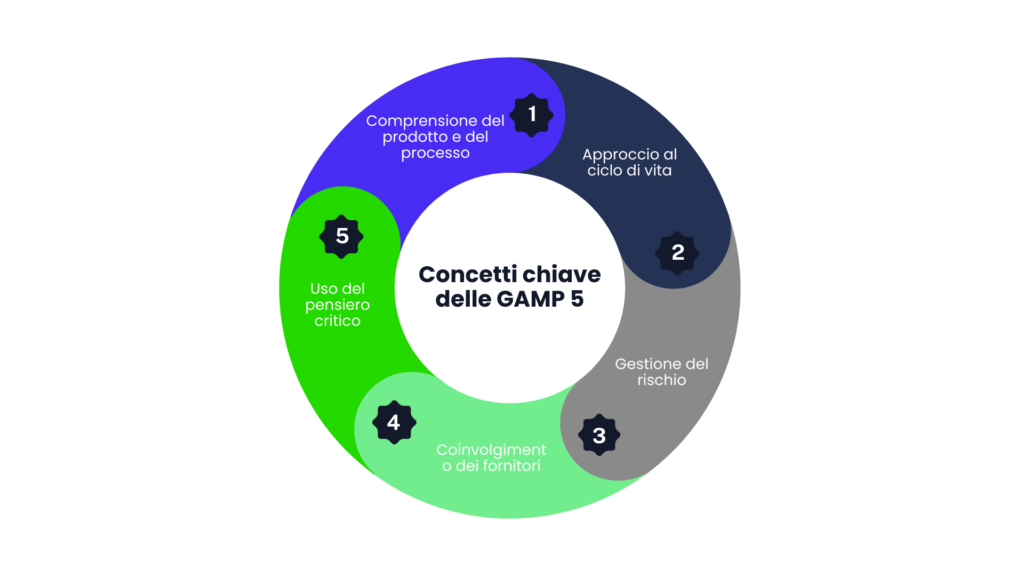
Concetti chiave delle GAMP 5
La seconda edizione delle GAMP 5 rafforza i quattro pilastri fondamentali:
- Comprensione del prodotto e del processo: Identificare i requisiti critici legati alla sicurezza del paziente e all’integrità dei dati. Questa comprensione è essenziale per progettare sistemi che garantiscano qualità e affidabilità.
- Approccio al ciclo di vita: Gestire ogni fase del sistema con un approccio scalabile in base alla complessità del progetto. L’intero ciclo di vita deve essere documentato per garantire trasparenza e tracciabilità.
- Gestione del rischio: Adottare misure proporzionate per mitigare i rischi. Questo include la classificazione dei rischi in base alla gravità e alla probabilità, con un focus sulla priorità delle aree critiche.
- Coinvolgimento dei fornitori: Collaborare attivamente con i fornitori per ottimizzare i processi di sviluppo e supporto. I fornitori devono essere scelti in base alla loro esperienza, conformità normativa e capacità di supporto a lungo termine.
Inoltre, è stato introdotto un quinto concetto:
- Uso del pensiero critico: Personalizzare le attività di convalida attraverso un’analisi razionale e mirata permettendo di ridurre sprechi e focalizzarsi sui requisiti essenziali.
Novità della Seconda Edizione delle GAMP 5
La seconda edizione è stata aggiornata per affrontare le sfide tecnologiche e normative moderne:
- Metodologia Agile: Supporta uno sviluppo iterativo e incrementale dei sistemi, migliorando la flessibilità e riducendo i tempi di implementazione.
- Allineamento ai Principi ALCOA+: Garantisce che i dati siano attribuibili, leggibili, contemporanei, originali e accurati, con enfasi su completezza e durabilità. Questa conformità è cruciale per soddisfare le normative globali.
- Tecnologie Emergenti: Appendici dedicate esplorano l’uso di blockchain, intelligenza artificiale e machine learning. Queste tecnologie possono migliorare la tracciabilità, ottimizzare i processi e ridurre i rischi operativi.
- Sicurezza Informatica: Maggiore attenzione alla protezione dei dati, con riferimenti agli standard ISO 27001 e NIST. La sicurezza è fondamentale per prevenire accessi non autorizzati e garantire la continuità operativa.
Obiettivi principali delle GAMP
Le GAMP hanno come obiettivo quello di garantire che i sistemi computerizzati siano idonei all’uso previsto e conformi alle normative vigenti. L’approccio si basa sulla gestione del rischio per identificare e mitigare le criticità, favorendo una stretta collaborazione tra utenti e fornitori per ottimizzare lo sviluppo e la manutenzione dei sistemi, riducendo gli sforzi duplicati e migliorando l’efficienza.
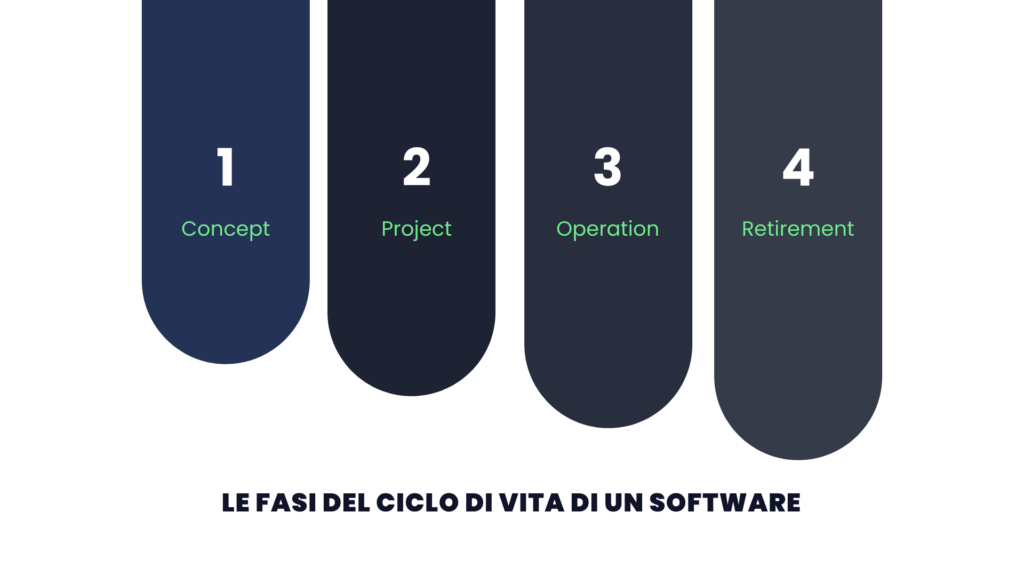
Le fasi del ciclo di vita di un software
Il ciclo di vita di un software include quattro fasi principali, ciascuna con obiettivi specifici e attività dettagliate per garantire l’idoneità e la conformità del sistema.
-Concept: Questa fase iniziale prevede l’identificazione dei requisiti del sistema, che devono essere ben definiti e documentati per assicurare una comprensione condivisa tra tutte le parti coinvolte. Un’analisi dei rischi preliminare aiuta a identificare le aree critiche che potrebbero influire sulla qualità del prodotto o sulla sicurezza del paziente, infatti, questo è il momento in cui si valutano e selezionano i fornitori più idonei verificandone l’esperienza, la competenza tecnica e la conformità ai requisiti normativi. La scelta non si limita ai costi ma considera anche la capacità di supporto a lungo termine e l’aderenza agli standard di qualità.
-Project: Nella fase di progetto, il sistema viene sviluppato seguendo specifiche funzionali e tecniche accuratamente definite. Questo include la creazione di un piano di convalida dettagliato che definisce gli obiettivi, le risorse e le tempistiche necessarie per ogni attività. La documentazione è essenziale in questa fase poiché include specifiche funzionali, di configurazione e test di qualifica (Installation Qualification, Operational Qualification e Performance Qualification) per verificare che il sistema funzioni correttamente e soddisfi le specifiche approvate. In aggiunta, durante il reporting, troviamo la valutazione delle lessons learned.
-Operation: Una volta implementato, il sistema entra nella fase operativa. Qui, è fondamentale monitorare costantemente le prestazioni del sistema per garantire che rimanga conforme ai requisiti e continui a soddisfare le esigenze aziendali. Un elemento chiave di questo stato è la gestione dei cambiamenti perché ogni modifica al sistema deve essere attentamente valutata, approvata e documentata per evitare effetti negativi sulla conformità o sull’integrità dei dati. È consigliato effettuare le revisioni periodiche per identificare potenziali problemi e opportunità di miglioramento, assicurando che il sistema continui a operare in modo efficace e sicuro.
-Retirement: L’ultima fase del ciclo di vita è dedicata alla disattivazione controllata dei sistemi obsoleti. Questo include la pianificazione del ritiro del sistema, assicurandosi che tutti i dati critici siano migrati in modo sicuro a un nuovo sistema o archiviati conformemente ai requisiti normativi. Un piano di decommissioning ben strutturato garantisce che il processo sia completato senza compromettere la disponibilità dei dati o la continuità operativa. Essendo la fase finale, è anche importante eseguire una valutazione complessiva per ottimizzare i processi futuri.
Applicazione delle normative nelle GAMP5
Le linee guida GAMP che regolano la convalida dei sistemi computerizzati sono fondamentali per garantire la sicurezza del paziente, l’integrità dei dati e la conformità alle normative vigenti. Tra le più rilevanti figurano il CFR 21 Part 11 della FDA, l’Annex 11 di Eudralex e l’ICH Q9, ciascuna con obiettivi e requisiti specifici.
-CFR 21 Part 11 della FDA: Questa normativa statunitense disciplina l’uso di documenti e firme elettroniche nel settore farmaceutico, assicurando che siano equivalenti alle loro controparti cartacee. Per essere conformi, i sistemi devono garantire sicurezza, autenticazione e tracciabilità dei dati, oltre a fornire audit trail completi che documentino tutte le modifiche effettuate.
-Annex 11 di Eudralex: L’Annex 11 fornisce linee guida specifiche per l’Unione Europea, focalizzandosi sulla gestione e sul controllo dei sistemi computerizzati. Questa normativa richiede che i sistemi siano progettati per garantire affidabilità e sicurezza dei dati, con un’enfasi particolare sulla protezione contro accessi non autorizzati e sulla capacità di ripristino in caso di guasti.
-ICH Q9: Questa guida internazionale promuove un approccio basato sulla gestione del rischio per assicurare la qualità dei prodotti farmaceutici. Applicata ai sistemi computerizzati, l’ICH Q9 incoraggia l’identificazione e la mitigazione dei rischi che potrebbero influire sulla qualità del prodotto o sulla sicurezza del paziente.
In aggiunta a queste normative, i principi ALCOA e ALCOA+ giocano un ruolo cruciale nella garanzia dell’integrità dei dati. Questi principi stabiliscono che i dati devono essere attribuibili, leggibili, contemporanei, originali e accurati, con ulteriori requisiti che includono completezza, coerenza, disponibilità e durabilità. L’aderenza a questi punti è fondamentale per garantire che i dati siano affidabili durante tutto il loro ciclo di vita.
Le aziende devono anche considerare gli standard di sicurezza informatica, come ISO 27001 e NIST, per proteggere i dati sensibili da accessi non autorizzati, perdita o manipolazione.
L’integrazione di queste normative e standard nella gestione dei sistemi computerizzati non solo garantisce la conformità, ma offre delle garanzie di standard elevate, migliorando la reputazione aziendale e riducendo il rischio di osservazioni.
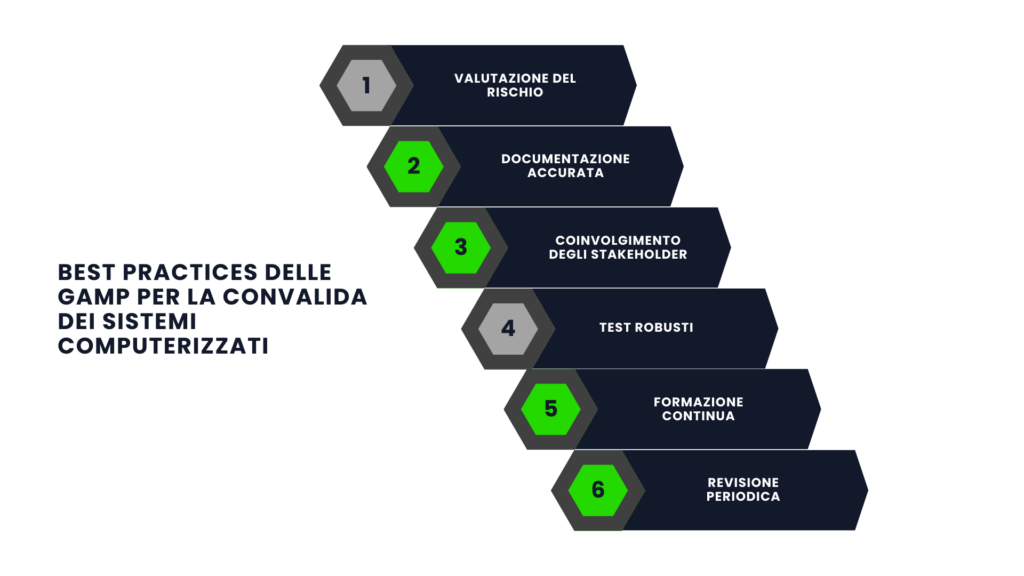
Best Practices delle GAMP per la convalida dei sistemi computerizzati
L’implementazione efficace delle GAMP richiede l’adozione di best practices specifiche:
- Valutazione del rischio: condurre un’analisi approfondita per identificare i rischi critici e definire le misure di controllo appropriate.
- Documentazione accurata: redigere e mantenere documenti chiari e completi che dimostrino la conformità normativa e tecnica.
- Coinvolgimento degli stakeholder: assicurare una collaborazione attiva tra team interfunzionali, inclusi utenti finali, fornitori e responsabili della qualità.
- Test robusti: implementare strategie di test che includano sia approcci standardizzati che esplorativi per garantire la copertura completa.
- Formazione continua: addestrare il personale sulle normative applicabili e sulle funzionalità dei sistemi per ridurre errori e aumentare l’efficienza.
- Revisione periodica: stabilire controlli regolari per monitorare l’efficacia del sistema e la conformità alle normative.
Implementazione delle GAMP nelle operazioni aziendali
Implementare le linee guida GAMP nelle operazioni aziendali richiede un approccio strategico e strutturato che garantisca l’integrazione delle best practices nelle attività quotidiane. La pianificazione è il fulcro di questo processo: definire chiaramente gli obiettivi, le responsabilità e le risorse necessarie permette di costruire una roadmap chiara e dettagliata.
Strumenti tecnologici moderni, come sistemi di gestione della qualità (QMS) e software di gestione della convalida, facilitano l’automazione delle attività ripetitive e migliorano la trasparenza e la tracciabilità delle operazioni. Grazie all’integrazione di queste tecnologie le aziende possono monitorare in tempo reale lo stato dei sistemi, identificare rapidamente anomalie e intervenire in modo proattivo.
La gestione del rischio, inoltre, è un elemento chiave: adottare un approccio basato sul rischio aiuta a concentrare gli sforzi sulle aree critiche, ottimizzando l’uso delle risorse. Parallelamente, è essenziale stabilire un processo di revisione periodica che permetta di valutare l’efficacia delle attività di convalida e di apportare eventuali miglioramenti.
Infine, la formazione continua del personale è cruciale per garantire che tutti i team coinvolti abbiano le competenze necessarie per gestire i sistemi computerizzati in modo efficace e conforme alle normative. Un’adeguata cultura della qualità aziendale supporta la sostenibilità a lungo termine delle pratiche GAMP, rendendo le operazioni aziendali più resilienti e performanti.
Conclusioni
Le linee guida GAMP rappresentano un punto di riferimento essenziale per le aziende farmaceutiche che utilizzano sistemi computerizzati. La seconda edizione delle GAMP 5 rafforza l’importanza di un approccio basato sul rischio, integrato con pensiero critico e tecnologie moderne, proprio per questo implementare determinate linee guida nelle operazioni aziendali non solo migliora la conformità normativa, ma garantisce anche maggiore efficienza, sicurezza e qualità nei processi produttivi.
Richiedi una consulenza in ambito CSV.


